

ランゲルハンス細胞組織球症(LCH)とは、血液細胞の一種である組織球が腫瘍化した病気で造血器悪性腫瘍です。乳幼児に多い疾患で、日本血液学会には年間60~70例、成人では年間15例ほどが疾患登録されており、まれな病気です。
様々な症状がでるため、患者さんは整形外科、呼吸器科、皮膚科、歯科、耳鼻科など様々な科を受診します。病気自体が珍しいため、なかなか診断がつかず、診断がついても適切な治療が行われないこともあります。
骨、肺、皮膚に病変が現れることが多く、骨痛、健診のレントゲン異常、皮膚にぶつぶつができるなどで気付かれることが多くあります。診断時には、病変部位が1つの臓器に限られる『単一臓器型LCH(例:骨のみに病変を認めるなど)』と、複数の臓器に病変が認められる『多臓器型LCH(例:骨、皮膚、脳に病変を認めるなど)』に分けられます。患者さんの割合は、単一臓器型が約4割、多臓器型が約6割です。
| ランゲルハンス細胞組織球症(LCH)の病型分類 | 説明 |
|---|---|
| 単一臓器型肺LCH | 肺のみに病変を認める |
| 単一臓器孤発型LCH | 1つの臓器に1つの病変のみ(例:骨1カ所) |
| 単一臓器多発型LCH | 1つの臓器にいくつか病変あり(例:骨複数箇所) |
| 多臓器型LCH | 複数の臓器に病変あり(例:皮膚、骨、肺) |
| 全身 | 発熱、黄疸、出血傾向 |
|---|---|
| 皮膚 | 皮疹(脂漏性湿疹、出血性丘疹) |
| 骨・軟部組織 | 骨痛、軟部腫瘤、椎体圧迫骨折 |
| 耳 | 中耳炎、外耳道炎、耳漏、難聴、めまい |
| 口腔 | 腫瘤、歯のぐらつき、歯茎の腫れ |
| 唾液腺・甲状腺 | 耳下腺腫脹、甲状腺腫脹 |
| 肺 | 咳、息切れ、のう胞、気胸、呼吸不全 *無症状で健康診断など画像検査で偶然発見されることもある。 |
| 肝・脾 | 腹水、肝脾腫 |
| 消化管 | 慢性下痢、粘膜潰瘍 |
| 骨髄 | 貧血、出血傾向 |
| リンパ系 | リンパ節腫脹 |
| 中枢神経 | 小脳失調、認知障害、運動障害 |
| 下垂体 | 尿崩症、下垂体前葉ホルモン分泌不全(低身長、不妊など) |
LCHの診断を確定するためには、病変部位(骨や皮膚など)の組織の一部を採取して顕微鏡で確認する『病理診断』が必要です。
LCH病変の広がりを評価するために、CT検査と骨シンチ検査、もしくはPET/CT検査、頭部MRI検査を行います。さらに血液検査では、炎症反応(CRPなど)、肝機能、腎機能、血液細胞数などを評価します。
ほとんどのLCH患者さんは、LCHの病変を持っていてもすぐに命に関わることはありません。ただし、リスク臓器(肝臓、脾臓、骨髄)に病変がある場合や、化学療法の治療効果が乏しい場合は予後が悪くなることがあります。また、中枢神経に病変が出現した場合は元に戻らない障害(中枢性尿崩症、中枢神経変性症など)を引き起こし、非常に重篤な状態となることがあります。
| 薬理分類 | 一般名 | 商品名 |
|---|---|---|
| 抗がん薬 | クラドリビン | ロイスタチン注® |
| BRAF阻害薬 | ダブラフェニブ | タフィンラー® |
| MEK阻害薬 | トラメチニブ | メキニスト® |
| 微小管阻害薬 | ビンブラスチン | エクザール® |
| 代謝拮抗薬 | シタラビン | キロサイド® |
| 代謝拮抗薬 | 6-メルカプトプリン | ロイケリン® |
| 代謝拮抗薬 | メトトレキサート | メソトレキセート® |
| 副腎皮質ステロイド薬 | プレドニゾロン | プレドニン® |
| 代謝拮抗薬 | ハイドロキシウレア±メソトレキサート | ハイドレア®±メソトレキセート® |
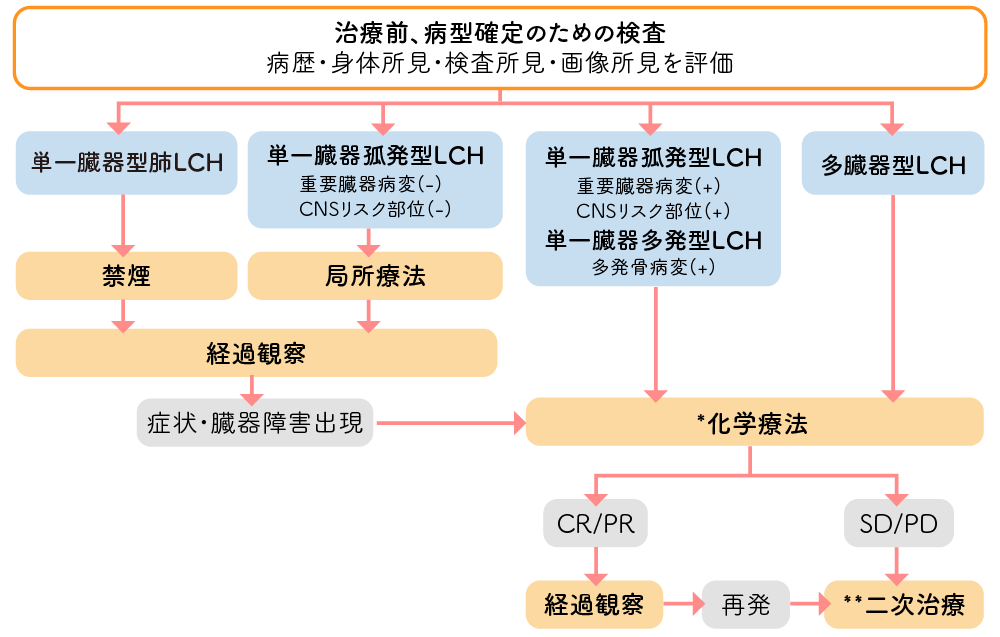
病変が1カ所のみの場合は化学療法を行わず、局所療法で厳重に経過観察を行います。
成人の単一臓器型・肺LCHは喫煙との関連が指摘されており、まずは禁煙し経過観察を行います。
以下の場合には、化学療法の適応となります。
標準的な化学療法としてSpecial-C療法*を実施します。
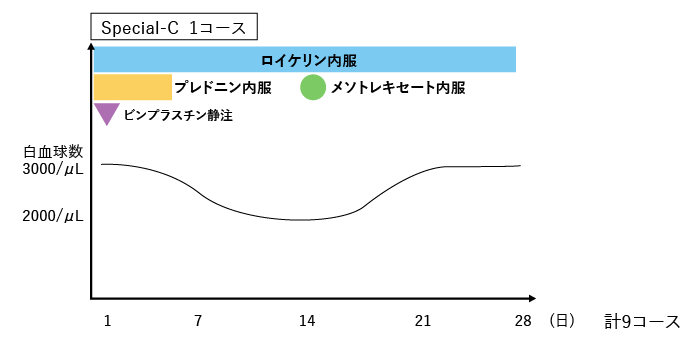
| 内容 | ビンブラスチン(エクザール®)、6-メルカプトプリン(ロイケリン®)、メトトレキサート(メソトレキセート®)、プレドニゾロン(プレドニン®) |
|---|---|
| スケジュール | 1コース28日間×9コース |
| 実施方法 | 外来治療(1コース目の最初の約2週間は可能であれば副作用確認のために入院が望ましい) |
| 主な副作用 | 血球減少、感染症、末梢神経障害、肝障害のほか、ステロイドによる高血糖・高脂血症・高血圧・便秘・消化管潰瘍・不眠・骨粗鬆症など |
初回のSpecial-C療法の効果が持続し、再発まで長い期間安定していた患者さんの場合には再度Special-C療法を行うこともあります。一方で、短期間で再発した場合や中枢神経に病変が出現した場合には以下の治療が検討されます。
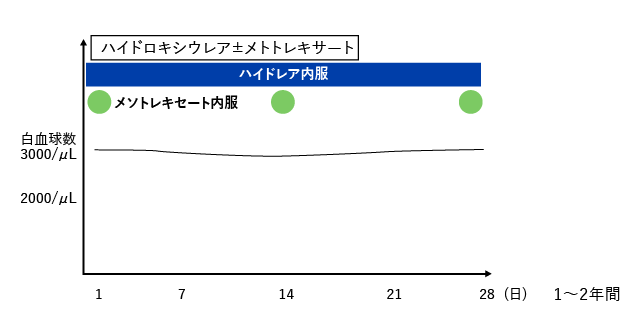
保健適応外
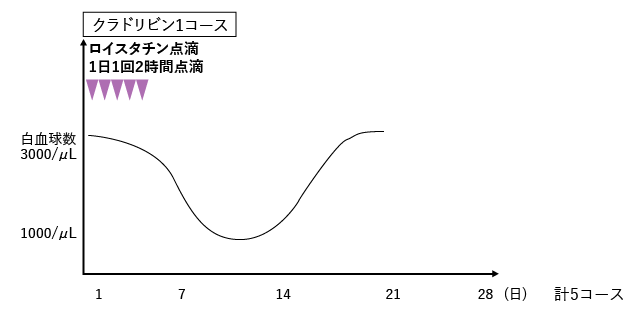
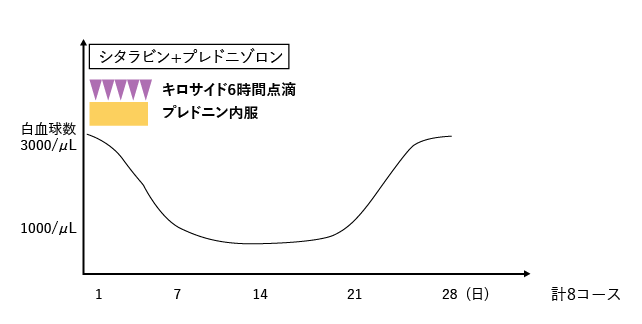
保健適応
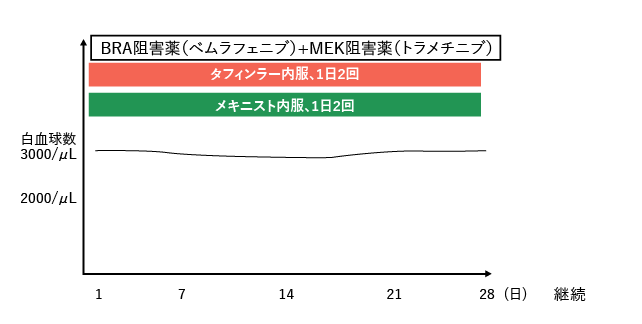
2023年11月より、発がん性の遺伝子変異であるBRAF遺伝子変異を有するLCHに対して、BRAF阻害薬とMEK阻害薬の併用内服治療が可能になりました。この治療は約8割の患者さんに治療効果が認められていますが、治療中止後の早期に4人に3人の割合で再発する可能性が高く、継続的な治療が必要です。そのため、現時点ではLCHが再発した場合や、LCHに対する化学療法の効果が乏しい患者さんに対して推奨されています。
約8割の方に治療効果(完全寛解、部分寛解)を認めますが、まれに初回治療の効果が弱い方では非常に予後が悪くなることがあります。治療後2~3年以内に約4割の方が再発することが課題とされていますが、再発時にも化学療法によって治療効果が得られることが多くあります。
ほとんどのLCH患者さんは、病変を持っていてもすぐに命に関わることはありません。しかし、長い経過の中で何らかの後遺症がでるといわれており、最も多い後遺症は下垂体後葉病変による中枢性尿崩症で、約3割の方に認められます。そのほか、側頭骨病変による難聴、肺病変による慢性呼吸不全、視床下部病変による記憶障害、まれにLCH関連中枢神経変性症による小脳失調症状や認知機能障害、二次性白血病などを生じることもあります。
※外部サイトへジャンプします
後遺症のリスクを軽減するためには、適切なタイミングで適切な治療をすることが重要です。
上記のように、ランゲルハンス細胞組織球症(LCH)は再発率が高いことが問題です。再発時の病状や再発までの期間、全身状態などを総合的に判断し、再度化学療法を行うことで治療効果を認めることが多いものの、何度も再発を繰り返すケースもあります。また、まれではありますが、初回治療に効果が認められない場合は予後が非常に悪くなることがあります。さらに、LCHの約1~2割の患者さんには、組織球系腫瘍の一種であるエルドハイム・チェスター病(ECD)が合併することがあり注意が必要です。
2010年に初めて、LCH細胞に発がん性のBRAF遺伝子変異を認めることが明らかになり、この遺伝子変異が作る物質を抑えるBRAF阻害薬とMEK阻害薬の併用療法がBRAF変異陽性のLCH患者さんに使用できるようになりました。これにより、治療の選択肢が広がり、治療開発が進んでいます。
最近では、LCH患者さんにBRAF遺伝子変異以外の遺伝子変異も見つかってきており、将来的にはそれらの遺伝子変異を標的とした新たな薬が使用できる可能性があります。LCH患者さんの病変組織や血液から遺伝子変異を検査することが可能のため、希望があれば検査を行っています。『医療機関登録制レジストリ』でも遺伝子変異検査を実施しています。こうした分子レベルの理解をもとに、今後の新しい治療方法の開発が期待されます。
